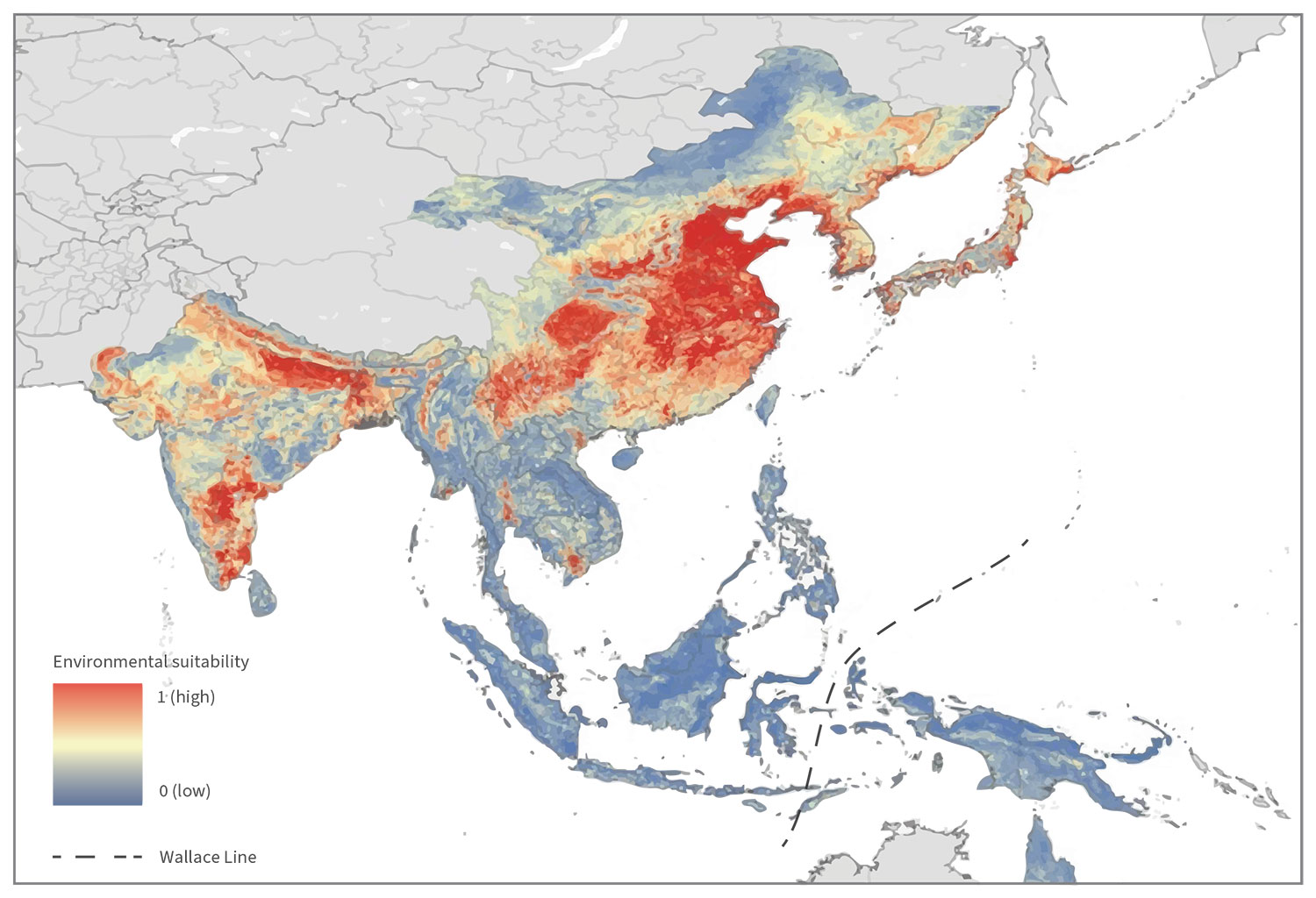
Un vaccin peut aider à les protéger
Pensez au risque. Pensez à la vaccination par IXIARO®.
Envisagez IXIARO® pour vos patients âgés de ≥ 2 mois pour la prévention de l’encéphalite japonaise1.
IXIARO® (vaccin contre l’encéphalite japonaise, inactivé, adsorbé), administré selon un schéma de 2 doses, est le seul vaccin contre l’encéphalite japonaise disponible au Canada22.
Pour obtenir plus d’information au sujet des schémas posologiques, cliquez ici.
Le vaccin contre l’encéphalite japonaise ne doit pas obligatoirement être fourni ni administré dans un centre de vaccination désigné par l’Agence de la santé publique du Canada22.
Envisagez IXIARO® chez vos patients âgés de 2 mois et plus présentant un risque d’exposition à l’encéphalite japonaise à l’occasion d’un voyage ou dans un cadre professionnel1.

Roberto, 20 ans
Jeune homme qui prévoit un voyage de 3 semaines en Thaïlande sans itinéraire

Thomas, 37 ans et Rose, 34 ans
Couple qui prévoit une visite familiale dans les Philippines

Patrick, 53 ans
Homme d’affaires qui séjourne au Vietnam durant 2 semaines pour la deuxième fois de l’année

Jonathan, 40 ans; Linda, 35 ans; Emma, 8 ans; et Noah, 14 mois
Famille qui visitera Bali durant 2 semaines
IXIARO® ne doit pas être utilisé durant la grossesse et l’allaitement1.
Ces cas de patients sont fictifs et sont fournis uniquement à des fins d’illustration.
IXIARO®– Une efficacité démontrée
IXIARO® offre une immunisation efficace démontrée contre le virus de l’encéphalite japonaise chez les adultes1†‡ .
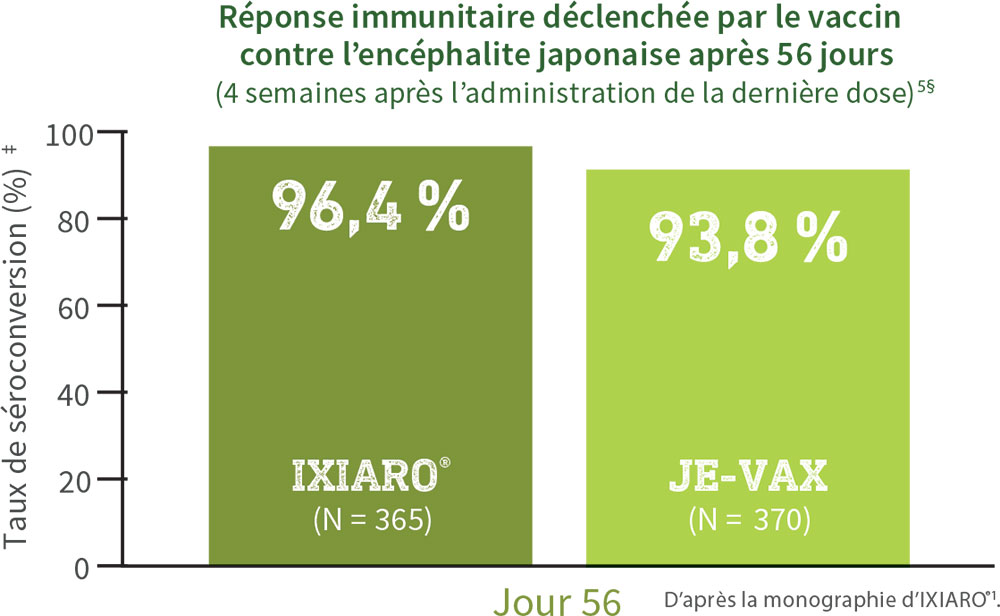
IXIARO® s’est révélé non inférieur au vaccin JE-VAX (estimation de la différence de risque [IC à 95 %] : 1,05 [-1,33; 3,43]).
IXIARO® confère une protection très efficace contre le virus de l’encéphalite japonaise1.
Dans une étude ouverte, il a également été démontré qu’IXIARO® procure une protection efficace contre le virus de l’encéphalite japonaise chez les enfants (critères d’évaluation secondaires)¶.
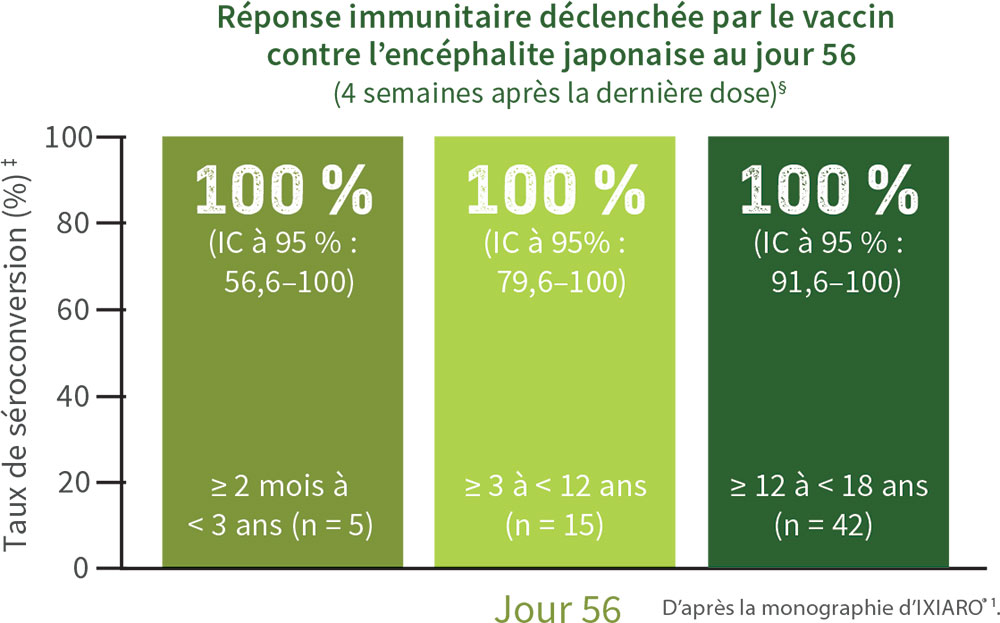
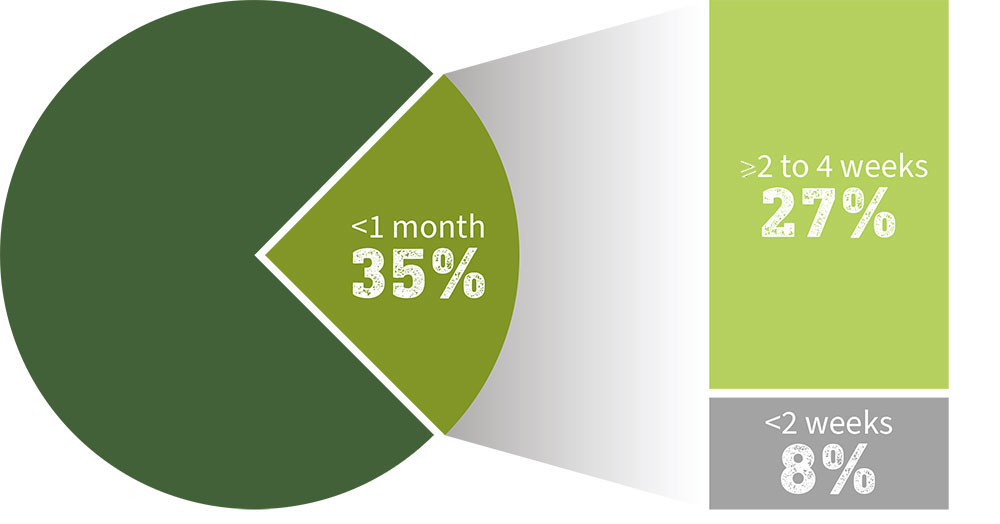
≥ 2 mois à < 3 ans (n = 5) : 100 % [IC à 95 %, 56,6-100]
≥ 3 ans à < 12 ans (n = 15) : 100 % [IC à 95 %, 79,6-100]
≥ 12 ans à < 18 ans (n = 42) : 100 % [IC à 95 %, 91,6-100]]
Y AXIS: Taux de séroconversion (%)
X AXIS: Jour 56
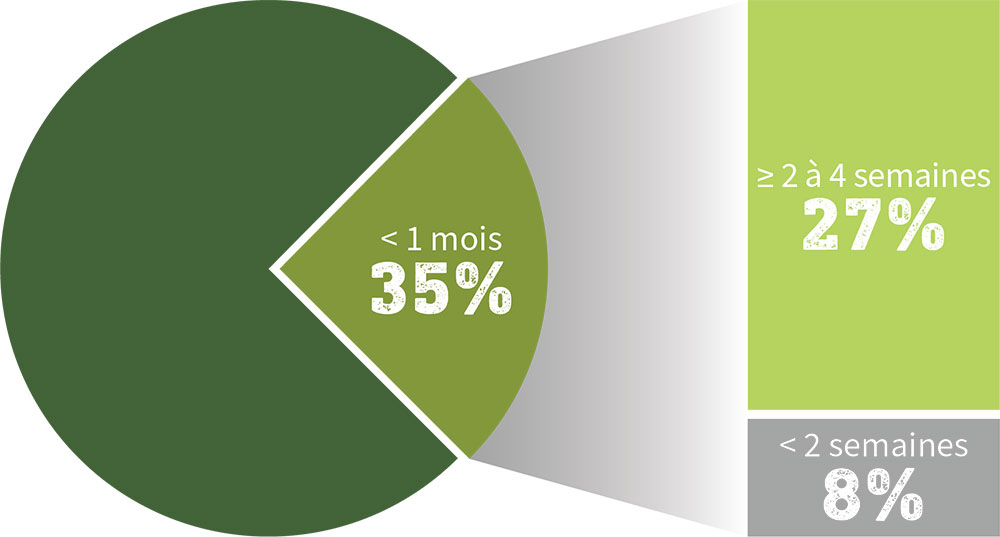
≥ 3 ans à < 12 ans (n = 15) : 100 % [IC à 95 %, 79,6-100]
≥ 12 ans à < 18 ans (n = 42) : 100 % [IC à 95 %, 91,6-100]]
Y AXIS: Taux de séroconversion (%)
X AXIS: Jour 56
Tous les enfants avaient atteint un TSC‡ de 100 % avec IXIARO® au jour 56
Comme avec tout autre vaccin, une vaccination par IXIARO® ne confère pas une protection dans tous les cas. IXIARO® ne protègera pas contre les encéphalites causées par d’autres micro-organismes1.
† Étude de non-infériorité de phase III, à répartition aléatoire, à témoin actif, à l’insu des observateurs sur IXIARO® comparativement à JE-VAX. Les patients ont reçu soit : 2 injections intramusculaires d’IXIARO® (6 mcg dans 0,5 mL) les jours 0 et 28 et 1 injection placebo de 0,5 mL le jour 7; soit : 3 injections sous-cutanées de JE-VAX (à la dose de 1,0 mL) les jours 0, 7 et 28, pour une durée de 6 mois1.
‡ La séroconversion (le taux seuil d’anticorps fournissant une protection) était définie comme étant un titre PRNT50 ≥ 1:10, tel que l’a recommandé l’Organisation mondiale de la Santé (OMS). L’analyse de l’efficacité clinique d’IXIARO® a été menée en utilisant cette valeur seuil1.
§ La portée clinique de cette comparaison est inconnue.
¶ Étude ouverte de phase III menée chez 100 enfants âgés de 2 mois à 18 ans. IXIARO® a été administré aux jours 0 et 28 à la dose de 0,25 mL chez les enfants âgés de ≥ 2 mois à < 3 ans, et à la dose de 0,5 mL chez des sujets âgés de ≥ 3 ans à < 18 ans. Le principal paramètre d’évaluation était le taux de sujets présentant des événements indésirables graves (EIG) et des événements indésirables (EI) nécessitant une attention médicale jusqu’au 56e jour après la première injection. Les taux de séroconversion au 56e jour et au 7e mois étaient des paramètres d’évaluation secondaires1.
TSC : taux de séroconversion.
IXIARO® a un profil d’innocuité et de tolérabilité bien établi
- Dans le cadre de l’analyse des données d’innocuité combinées (n = 4043), les effets indésirables les plus fréquents chez les adultes en santé âgés de 18 à 86 ans comprenaient1 :
- Céphalées (20 %), myalgie (13 %), fatigue (13 %), douleur au point d’injection (33 %) et sensibilité au point d’injection (33 %).
- Les effets indésirables les plus souvent rapportés durant les essais cliniques (n = 1559) chez les enfants et les adolescents comprenaient1 :
- Enfants âgés de 2 mois à < 3 ans : pyrexie (28,5 %), diarrhée (11,9 %), affection de type grippal (10,9 %), irritabilité (10,9 %) et réactions au point d’injection (9,6 %).
- Enfants âgés de 3 à < 18 ans : réactions au point d’injection (20,4 %), pyrexie (10,4 %), myalgie (7,1 %), céphalées (6,1 %) et fatigue (3,5 %).
Posologie et administration
Posologie et administration chez les adultes
Calendrier d’administration recommandé en deux doses chez les adultes1

- Les données sur la séroprotection à long terme à la suite d’une première dose de rappel administrée 12 à 24 mois après l’immunisation primaire laissent entendre qu’une 2e dose de rappel devrait être administrée 10 ans après la première dose de rappel et avant une exposition potentielle au virus de l’encéphalite japonaise.
La représentation graphique n’est pas à l’échelle.
Posologie et administration chez les enfants

- Une dose de rappel devrait être administrée au cours de la deuxième année (c’est-à-dire dans les 12 à 24 mois) après l’immunisation primaire, avant une éventuelle réexposition au virus de l’encéphalite japonaise.
- Les enfants et adolescents exposés à un risque continu de contracter l’encéphalite japonaise (résidant en zone endémique) devraient recevoir une dose de rappel au 12e mois après la vaccination primaire.
- Les enfants et adolescents de 3 ans à moins de 18 ans devraient recevoir une dose unique de rappel de 0,5 mL.
- Les enfants de 14 mois à < 3 ans devraient recevoir une dose unique de rappel de 0,25 mL.
- Aucune donnée de séroprotection à long terme au-delà de deux ans après un premier rappel administrée 1 an après l’immunisation primaire n’est disponible chez les enfants.
La représentation graphique n’est pas à l’échelle.
- La dose recommandée pour les adultes âgés de 18 ans et plus est de 0,5 mL par dose1.
- La dose recommandée pour les enfants et les adolescents de 3 à 18 ans est de 0,5 mL par dose1.
- La dose recommandée pour les enfants âgés de 2 mois à moins de 3 ans est de 0,25 mL par dose1.
- Il est recommandé aux personnes vaccinées qui ont reçu la première dose d’IXIARO® de terminer le cycle primaire de vaccination de 2 doses avec IXIARO®1.
- Le vaccin doit être administré par injection intramusculaire (IM) seulement1†.
- Si la co-administration d’un autre vaccin est indiquée, la vaccination devrait être effectuée dans des membres différents1.
Comme avec tous les vaccins injectables, il convient de toujours avoir un traitement médical approprié à portée de la main et d’assurer une surveillance pour le rare cas où surviendrait une réaction anaphylactique après l’administration du vaccin1.
Consultez la monographie de produit pour obtenir les instructions complètes concernant la posologie et l’administration.
* Dans le cas où la série primaire (jour 0 et jour 28) ne peut pas être complétée en raison de contraintes de temps, un schéma d’immunisation rapide peut être appliqué (c’est-à-dire la première dose au jour 0 et la deuxième dose au jour 7) chez les personnes âgées de 18 à 65 ans.
† Exceptionnellement, IXIARO® peut être administré par voie sous-cutanée chez les patients atteints de thrombocytopénie ou de troubles de la coagulation, car un saignement peut se produire à la suite d’une administration intramusculaire. L’administration sous-cutanée pourrait conduire à une réponse sous-optimale au vaccin. Il convient toutefois de souligner qu’il n’existe pas de données d’efficacité clinique appuyant l’administration par voie sous-cutanée.
‡ Aucune donnée n’appuie l’utilisation du calendrier de vaccination accéléré chez les enfants et les adolescents (de 2 mois à 17 ans).
Renseignements supplémentaires
Caractéristiques du produit
IXIARO® est un vaccin à virus purifié et inactivé de l’encéphalite japonaise. Le virus est cultivé dans des cellules Vero, purifié, inactivé, puis adsorbé sur hydroxyde d’aluminium. Le vaccin final se présente sous la forme d’une suspension dans une seringue préremplie. Chaque dose unitaire d’IXIARO® contient le virus inactivé de l’encéphalite japonaise, souche SA14‑14‑2 ayant une puissance ≤ 460 ng ED50 par 0,5 mL. Le vaccin ne contient ni conservateur ni antibiotique1.
Séroconversion
L’analyse de l’efficacité clinique a été réalisée en plaçant le seuil du titre d’anticorps neutralisant à ≥ 1:10, ce qui est aussi le critère de séroconversion. La séroconversion ou le niveau seuil d’anticorps permettant d’assurer une protection est défini comme un titre de PRNT50 ≥ 1:10, titre recommandé par le groupe de consultation de l’Organisation mondiale de la Santé (OMS) qui est largement utilisé dans le monde. Les expériences réalisées chez la souris ont également confirmé les données ci-dessus. Le PRNT, ou test de neutralisation par réduction des plages, mesure le titre d’anticorps neutralisant le virus qui correspond à une protection. Le titre d’anticorps neutralisant le virus est exprimé en dilution sérique donnant une réduction de plage ou de virus de 50 % (PRNT50) par rapport à la plage de 100 % formée dans l’élément témoin viral seul. Tous les résultats de PRNT50 sont exprimés en titres réciproques. La MGT a été définie comme moyenne géométrique des titres de PRNT501.