One vaccine can help protect them
Consider their risk. Consider immunization with IXIARO®.
Consider IXIARO® for your patients aged ≥2 months for the prevention of JE1
IXIARO® (Japanese Encephalitis vaccine inactivated, adsorbed), administered in a 2-dose vaccine schedule, is the only JE vaccine available in Canada.22
For more information on dosing schedules click here.
JE vaccine does not require to be dispensed or administered in a designated Public Health Agency of Canada Vaccination Center.22
Consider IXIARO® for your patients older than 2 months old at risk of JE exposure through travel or during their occupation.1

Roberto, 20
A young man visiting Thailand for 3 weeks without an itinerary

Tyler, 37 & Rosa, 34
A couple visiting family in the Philippines

Patrick, 53
A businessman travelling for 2 weeks to Vietnam for the second time in the past year

Jonathan 40, Linda 35, Emma 8, Noah 14 months
A family visiting Bali for 2 weeks
Use of IXIARO® during pregnancy or lactation should be avoided.1
For illustrative purpose only. Does not depict actual patient cases.
IXIARO® demonstrated efficacy
IXIARO® has been shown to provide effective immunization against JEV in adults1†‡
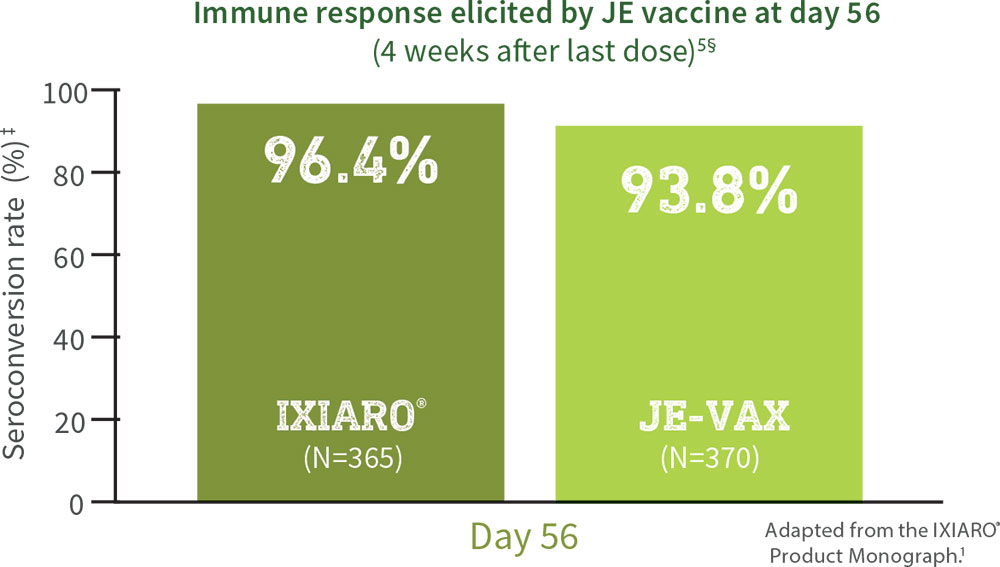
IXIARO® showed non-inferiority vs. JE-VAX (Risk difference estimate [95% CI]: 1.05 [-1.33; 3.43])
IXIARO® offers highly effective protection against JEV1
IXIARO® has also demonstrated effective immunization against JEV in pediatric populations in an open label study (secondary endpoints)¶
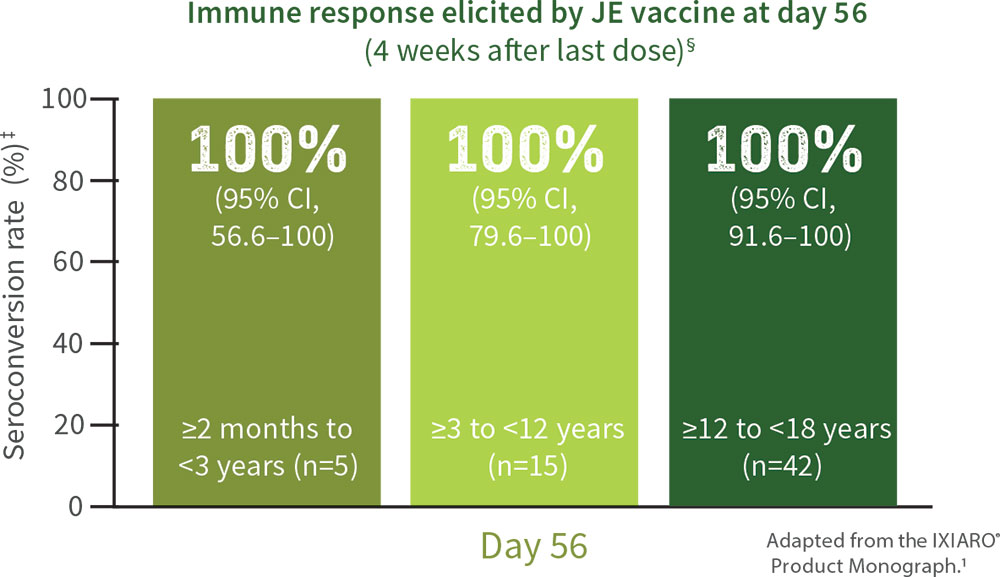
≥2 months to <3 years (n=5): 100% [95% CI, 56.6-100]
≥3 to <12 years (n=15): 100% [95% CI, 79.6-100]
≥12 to <18 years (n=42): 100% [95% CI, 91.6-100]
Y AXIS: Seroconversion rate (%)
X AXIS: Day 56
≥3 to <12 years (n=15): 100% [95% CI, 79.6-100]
≥12 to <18 years (n=42): 100% [95% CI, 91.6-100]
Y AXIS: Seroconversion rate (%)
X AXIS: Day 56
All pediatric subjects achieved SCR‡ rates of 100% with IXIARO® at day 56
As with any other vaccine, vaccination with IXIARO® may not result in protection in all cases. IXIARO® will not protect against encephalitis caused by other micro-organisms.1
†
A randomized, active controlled, observer-blinded, non-inferiority, phase 3 study for IXIARO® vs. JE-VAX. Patients were either given 2 injections of IXIARO® (6 mcg in 0.5 mL) intramuscularly on days 0 and 28 and 1 injection 0.5 mL placebo vaccine at day 7, or 3 subcutaneous injections of JE-VAX (1.0 mL dose) on days 0, 7 and 28 for a duration of 6 months.1
‡
Seroconversion (the threshold antibody level for protection) is defined as a PRNT50 titre ≥1:10, as recommended by the World Health Organization (WHO). The analysis of clinical efficacy for IXIARO® was done using this value as a cutoff.1
§
Comparative clinical significance unknown.
¶
Open‐label, pediatric, phase 3 study conducted in 100 children aged 2 months to 18 years. IXIARO® was administered days 0 and 28 at a dose of 0.25 mL in children ≥2 months to <3 years, at a dose of 0.5 mL in subjects aged ≥3 years to <18 years old. Primary endpoint was rate of subjects with serious adverse events (SAEs) and medically-attended adverse events (AEs) up to Day 56 after the first vaccination. SCRs at day 56 and month 7 were secondary endpoints.1
SCR: seroconversion rate.
IXIARO® has an established safety and tolerability profile
- The most common adverse reactions in the pooled safety analysis (n=4,043) in healthy adults aged 18 to 86 years included:1
- Headache (incidence, 20%), myalgia (13%), fatigue (13%), injection site pain (33%) and injection site tenderness (33%)
- The most common adverse reactions in clinical trials (n=1,559) in children and adolescents included:1
- Children 2 months to <3 years old: pyrexia (28.5%), diarrhea (11.9%), influenza like illness (10.9%), irritability (10.9%), and injections site reactions (9.6%)
- Children 3 years to <18 years old: injections site reactions (20.4%), pyrexia (10.4%), myalgia (7.1%), headache (6.1%) and fatigue (3.5%)
Dosing and administration
Dosing and administration in adults
Recommended two-dose schedule in adults1
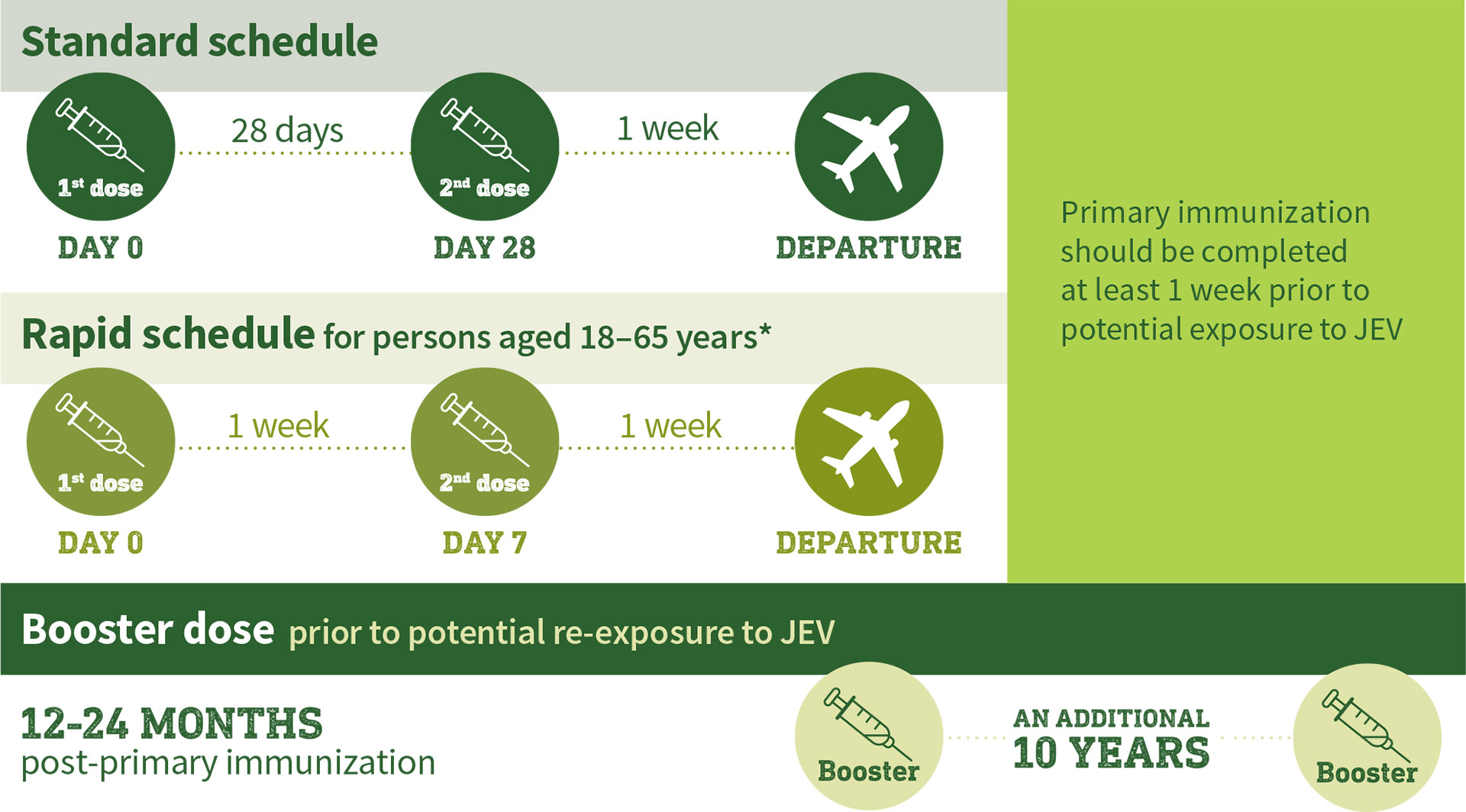
- Long-term seroprotection data following a first booster dose administered 12–24 months after primary immunization suggest that a second booster should be given 10 years after the first booster dose, prior to potential exposure to JEV.
Graphic not made to scale.
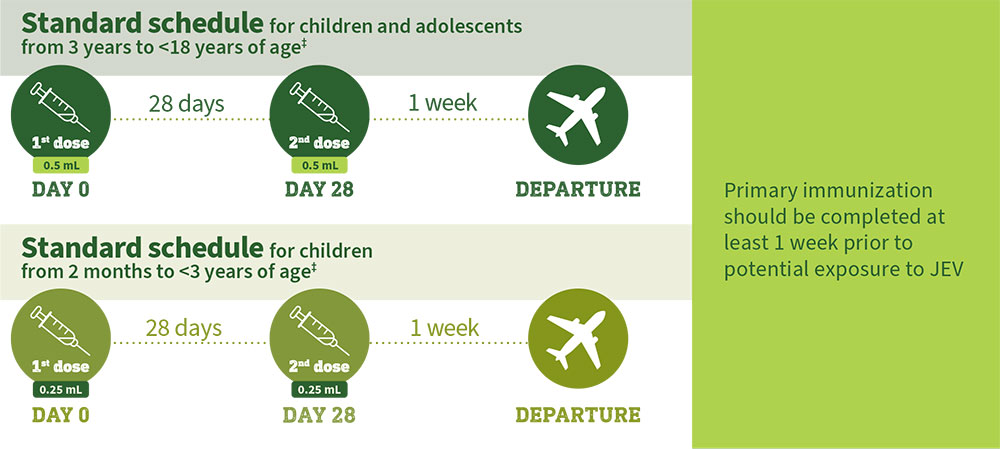
Dosing and administration in pediatric populations
Booster dose prior to potential re-exposure to JEV
- A booster dose should be given within the second year (12 – 24 months) after primary immunization, prior to potential re-exposure to JEV.
- Children and adolescents at continuous risk for acquiring JE (residing in endemic areas) should receive a booster dose at month 12 after primary immunization.
- Children and adolescents from 3 years to <18 years of age should receive a single 0.5 mL booster dose.
- Children from 14 months to <3 years of age should receive a single 0.25 mL booster dose.
- No long-term seroprotection data beyond two years after a first booster administered 1 year after primary immunization has been generated in children.
Graphic not made to scale.
- The recommended dose for adults 18 years of age and older is 0.5 mL per dose1
- The recommended dose for children and adolescents 3 to 18 years old is 0.5 mL per dose1
- The recommended dose for children from 2 months to less than 3 years is 0.25 mL per dose1
- It is recommended that vaccinees who received the first dose of IXIARO® complete the primary 2-dose vaccination course with IXIARO®1
- Administration is by intramuscular (IM) injection only1†
- If co-administration with another vaccine is indicated, immunization should be carried out on separate limbs1
As with all injectable vaccines, appropriate medical treatment and supervision should always be available to treat rare cases of anaphylactic reactions following the administration of the vaccine.1
Please see the Product Monograph for complete dosing and administration instructions.
* In the event the primary series (Day 0 and Day 28) cannot be completed due to time constraints, a rapid immunization schedule (i.e. first dose at Day 0 and second dose at Day 7) in persons aged 18–65 years may be used.
† Exceptionally, IXIARO® may also be administered subcutaneously to patients with thrombocytopenia or bleeding disorders since bleeding may occur following an intramuscular administration. Subcutaneous administration could lead to a suboptimal response to the vaccine. There are no clinical efficacy data to support administration by the subcutaneous route.
‡ There are no data to support a rapid immunization schedule in children and adolescents (2 months to 17 year of age).
Additional information
Product characteristics
IXIARO® is a purified and inactivated JEV vaccine. The virus is grown in Vero cells, purified, inactivated, and then adsorbed on aluminium hydroxide. The final vaccine is in the form of a suspension in a pre-filled syringe. Each unit dose of IXIARO® contains inactivated JEV, strain SA14-14-2 having a potency ≤460 ng ED50 per 0.5 mL. The vaccine does not contain any preservative or antibiotic.1
Seroconversion
The analysis of clinical efficacy was done using a cutoff of a neutralizing antibody titre of ≥1:10, which was also used as a criterion for Seroconversion. Seroconversion or the threshold antibody level for protection is defined as a PRNT50 titre ≥1:10, as recommended by the World Health Organization (WHO) consultation group and is widely used worldwide. Experiments done in mice also confirmed the above mentioned fact. The PRNT or Plaque neutralization assay, measures virus neutralizing antibody that correlates with protection. The virus neutralising antibody titre is expressed as the serum dilution giving a 50% plaque or virus reduction (PRNT50) compared to 100% plaque formation in virus only control. All PRNT50 results are expressed as reciprocal titres. GMT was defined as the geometric mean of PRNT50 titres.1